Електричний струм в електролітах
 |
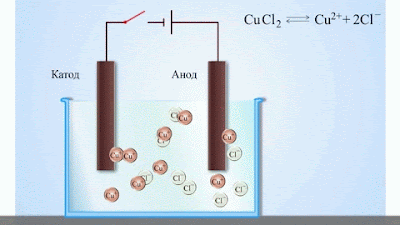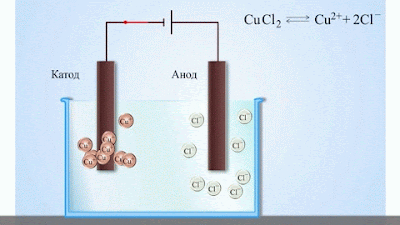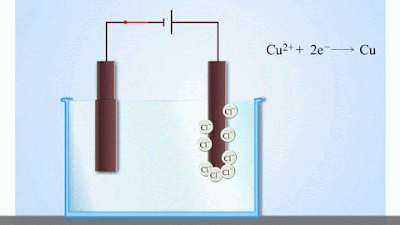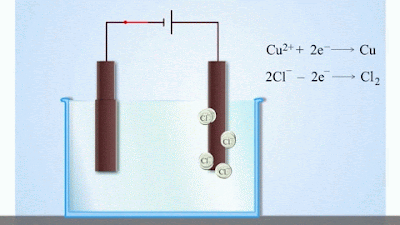
| Мал 1. Електроліз водного розчину хлориду міді |
- Електролітами називають провідні середовища, в яких протікання електричного струму супроводжується перенесенням речовини.
- До електролітів відносяться водні розчини кислот, солей і лугів а також розплави деяких твердих речовин.
- Проходження струму крізь електроліт супроводжується виділенням речовини на електродах. Це явище називають електролізом.
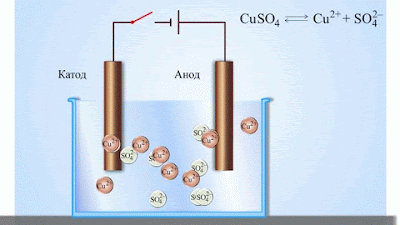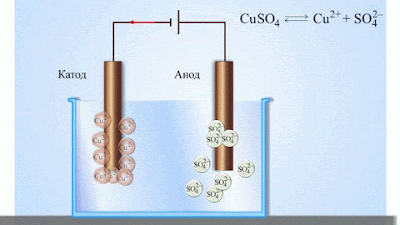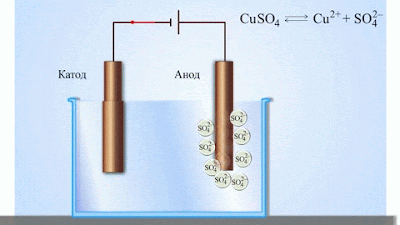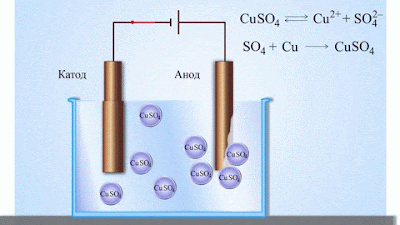
- Електричний струм в електролітах представляє собою переміщення іонів обох знаків в протилежних напрямах. Додатні іони рухаються до від’ємного електрода (катода), від’ємні іони – до додатного електрода (анода). Іони обох знаків з’являються в водних розчинах солей, кислот і лугів в результаті розчеплення частини нейтральних молекул. Це явище називають електролітичною дисоціацією.
Наприклад, хлорид міді CuCl2 дисоціює в водному розчині на іони міді та хлору:
- При підключенні електродів до джерела струму іони під дією електричного поля починають впорядкований рух: додатні іони міді рухаються до катода, а від’ємні йони хлору – до анода (мал.1).
- Досягнувши катода, іони міді нейтралізуються надлишковими електронами катода і перетворюються в нейтральні атоми, які виділяються (осідають) на катоді. Йони хлору, досягнувши анод, віддають по одному електрону. Після цього нейтральні атоми хлору з’єднуються попарно і утворюють молекули хлору Cl2. Хлор виділяється на аноді в виді бульбашок газу.
Отже, при проходженні електричного струму крізь електроліт на електродах виділяється речовина (в нашому прикладі мідь і хлор).
- Закон електролізу був експериментально встановлений англійським фізиком М. Фарадеєм в 1833 році. Закон Фарадея визначає масу речовини, яка виділяється на електродах під час електролізу:
Маса m речовини, яка виділяється на електроді, прямо пропорційна заряду Q, який пройшов крізь електроліт:
m = kQ = kIt
Величину k називають електрохімічним еквівалентом.
- Маса речовини, яка виділиться на електроді дорівнює масі всіх іонів, які прийшли на електрод:
m = m0N = m0∙Q/q0 = m0∙It/q0.
Тут m0 і q0 – маса і заряд одного іона, а N = Q/q0 – число iонів, які прийшли на електрод при проходженні через електроліт заряду Q.
- Отже, електрохімічний еквівалент k дорівнює відношенню маси іона m0 до його заряду q0.
- Оскільки заряд іона дорівнює добуткові валентності речовини z на елементарний заряд e (q0 = z∙e), то вираз для електрохімічного еквівалента k можна записати так:

Тут NA –стала Авогадро, M = m0NA – молярна маса, F = eNA –стала Фарадея.
F = eNA = 96485 Кл / моль.
- Закон Фарадея для електролізу можна записати так:

Електроліз в розчині мідного купоросу з мідними електродами
Доцільно прочитати: